从《2024年度药品审评告诉》看中邦改进药发达趋向与机会
公司新闻
公司新闻
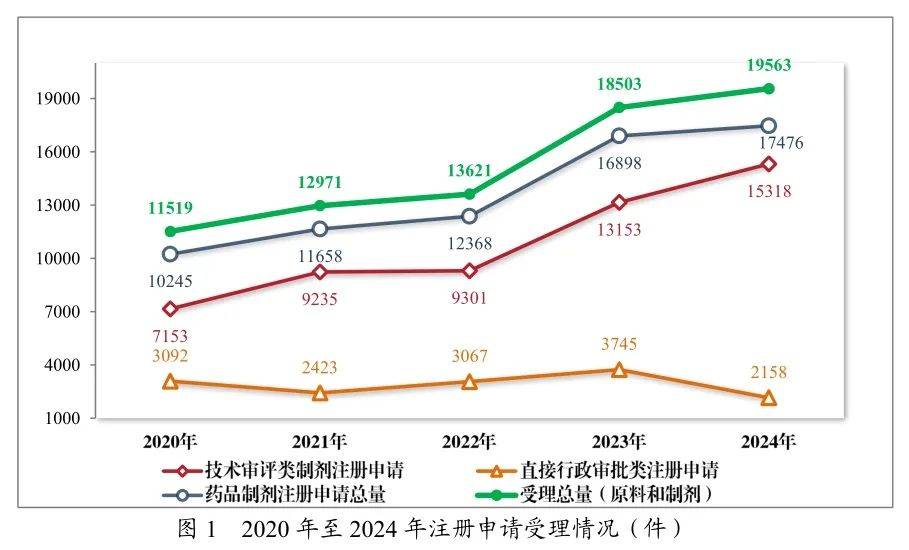
3月18日,CDE重磅揭晓《2024年度药品审评告诉》,终年容许48款1类改进药、55款罕睹病用药、106款儿童用药;受理的15318件工夫审评类药品注册申请中,以药品类型统计,化学药品注册申请10464件,中药注册申请2407件,生物成品注册申请2447件。创史籍新高!
这场厘革背后,是策略救援儿童药品清单、工夫冲破与邦际合营三重盈利的加持,一个属于中邦药企的“黄金时期”正加快到来。
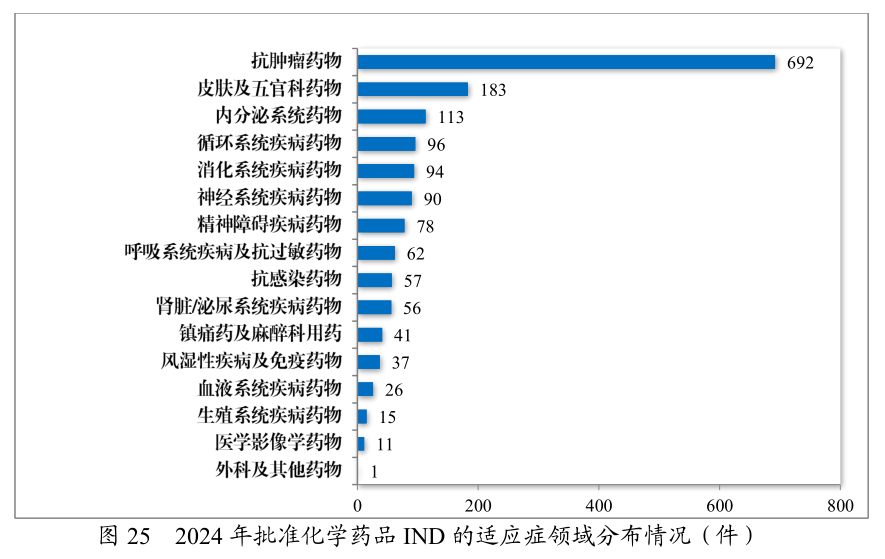
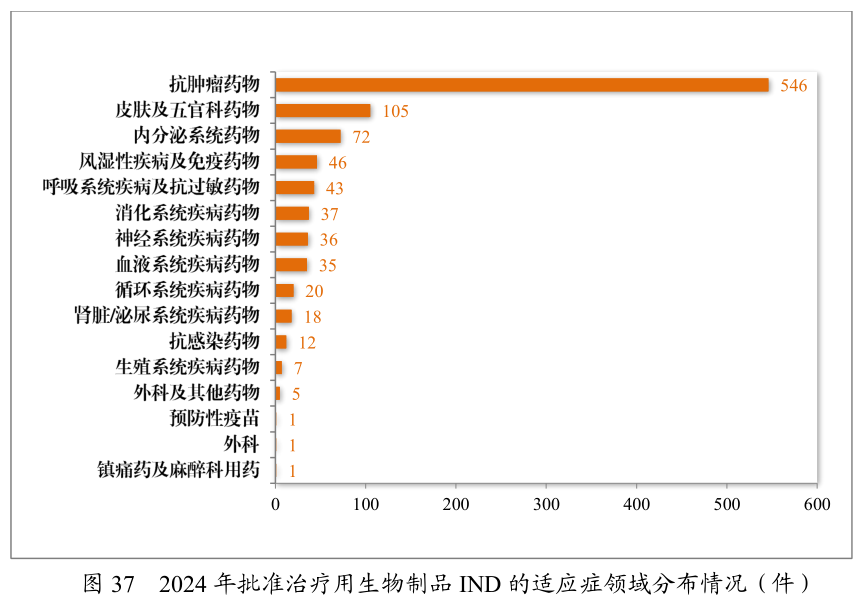
2024年容许的临床试验申请中,抗肿瘤药的占比是最高,此中化学药品是到达41.89%,生物成品到达55.43%上;91款药物被纳入冲破性医疗步骤(2023年60款),抗肿瘤药占比超50%。自2020年《药品注册处置主意》推行今后,共有187件药品注册申请(135项适当症)附条目容许上市,此中抗肿瘤药物占比82.22%;共有496件药品注册申请纳入优先审评审批步骤,此中抗肿瘤药物占比最众,为42.54%。
产物方面,如科济药业BCMA靶向CAR-T产物泽沃基奥仑赛获优先审评、冲破性医疗及附条目容许三项资历,用于复发/难治性众发性骨髓瘤;传奇生物同类CAR-T疗法西达基奥仑赛通过冲破性医疗与附条目容许上市,适当症同为众发性骨髓瘤;石药集团PD-1单抗恩朗苏拜单抗获附条目容许,用于复发或转变性宫颈癌患者……众款改进疗法均剑指临床急需范围,外示中邦改进药研发新冲破。
但兴隆背后潜伏隐忧,PD-1/HER2等热门靶点占领抗肿瘤药物总量的40%,导致研发资源太过会合。以PD-1单抗为例,环球正在研PD-1/PD-L1药物超500种,中邦占1/3,但创办靶点仍为空缺。这种扎推式研发、同质化角逐不单形成研发进入滥用,更不妨激发另日医保商议中的代价血战。从工程化更正到靶点改进的政策突围,已成为工业转型升级的必答题。
美迪西已构修了440+肿瘤药效模子,蕴涵118+种PDX模子、同种肿瘤移植模子、异种肿瘤移植模子、人源化肿瘤移植模子等,可一站式助力肿瘤药物研发!
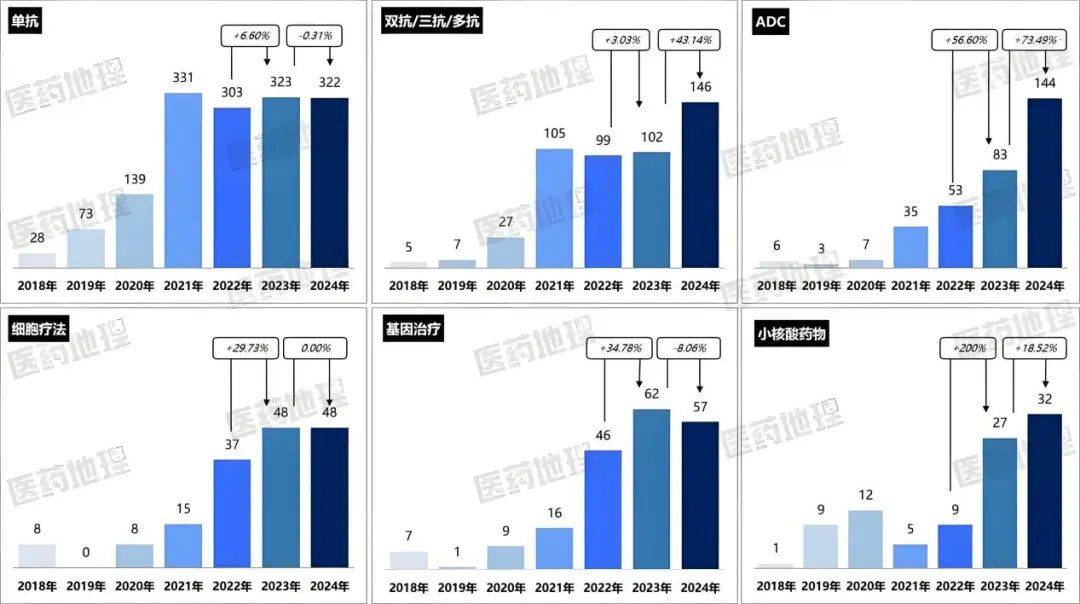
2024年,双抗/三抗、ADC、小核酸、细胞疗法等药物的IND申请数目均创史籍新高。回溯2018-2024年,中邦1类或1.1类化学药品和生物成品的改进药临床试验(IND)申请数目浮现动摇上升趋向,此中ADC药物范围接续维系50%以上的年伸长率,细胞与基因医疗(CGT)范围也继续扩容。
众项冲破性结果令人夺目,如瑞普晨创的CiPSC胰岛细胞疗法进入糖尿病临床试验,恒瑞医药的PD-1/TGF-β双抗启动胃癌一线医疗申报,荣昌生物原创ADC维迪西妥单抗第3项适当症上市申请获受理并纳入优先审评,医疗HER2阳性肝转变晚期乳腺癌患者等。
新分子实体药物占比晋升,反应着商场药物从Me-too向 First-in-class的转型。跟着工夫的继续先进与行使拓展,新分子实体药物研发将迎来更众冲破,饱舞改进药行业向更高秤谌生长。
正在新分子药物研发范围,美迪西已搭修了涵盖ADC、PROTAC、核酸、双抗、众肽、疫苗及细胞&基因医疗的新分子药物研发办事平台,已助力28件ADC药物、5件PROTAC药物、34件抗体药物、1件核酸药物等获批临床(数据截至2024年终)。
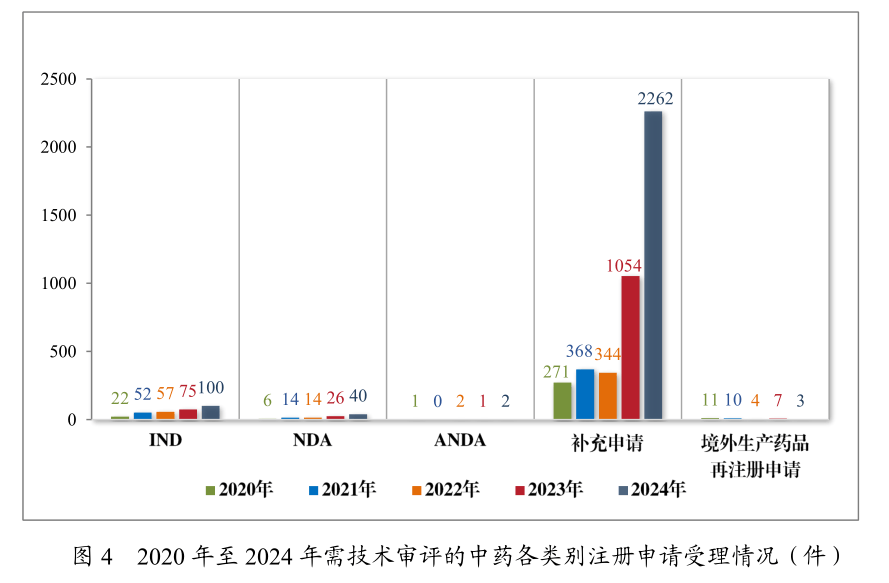
2024年,中医药改进迎来发作式伸长,受理中药IND申请达100件,同比伸长33.33%,此中改进中药占比80%。正在获批的14款中药新药中,11款为改进中药,呼吸、消化范围占比39.34%。古代经典名方复方制剂的NDA申请达28件,外示了对古板中药资源的发掘和改进应用。
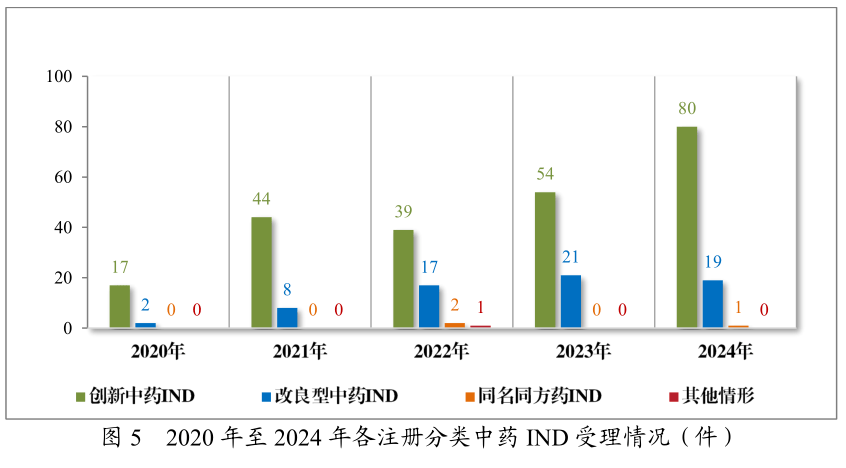
值得合心的是,1.1类新药如齐进药业的儿茶上清丸、卓和药业的九味止咳口服液(针对风热咳嗽的呼吸科地步级药物)、成都华西自然药物有限公司的秦威颗粒(首款专治急性痛风性合节炎的改进中药),均外示出中医药正在疑问病症医疗中的特殊代价。其它,古代经典名方复方制剂的新药上市申请(NDA)达28件,此中9款得胜获批,如武汉康乐药业的芍药甘草颗粒、华润三九的苓桂术甘颗粒及温经汤颗粒等经典名方制剂等,实行了古板医学聪颖的新颖化转化。
假使此刻中药改进药申请量仅为化学药的五分之一,但跟着药理学揭示众靶点协同机制、编制生物学阐明效力机理,中药正在慢性病处置、疑问病医疗中的特殊上风正渐渐展现,邦际商场对植物药和整合医学的认同,更为中医药新颖化供应了史籍性机缘。
正在中药范围,美迪西已搭修一站式中药临床前研发办事平台,遮盖药学查究、药效学、药代动力学以及毒理学等众个合节合头,加快研发过程。
2024年,容许罕睹病用药55个种类(未蕴涵化学药品4类仿制药),同比伸长40%,此中20个种类通过优先审评审批步骤加疾上市,2个种类附条目容许上市,遮盖血友病、脊髓性肌萎缩症等天价药物;容许儿童用药106个种类,包罗71个上市许可申请,此中20个种类通过优先审评审批步骤加疾上市;另容许35个种类扩展儿童适当症,缓解儿科“用药靠掰”困难。这两大范围长久受困于研发慌境——环球7000余种罕睹病仅5%有药可治,儿童用药因临床试验庞杂、商场范畴有限,长久依赖成人药物剂量调度,导致不良反响危机高企。
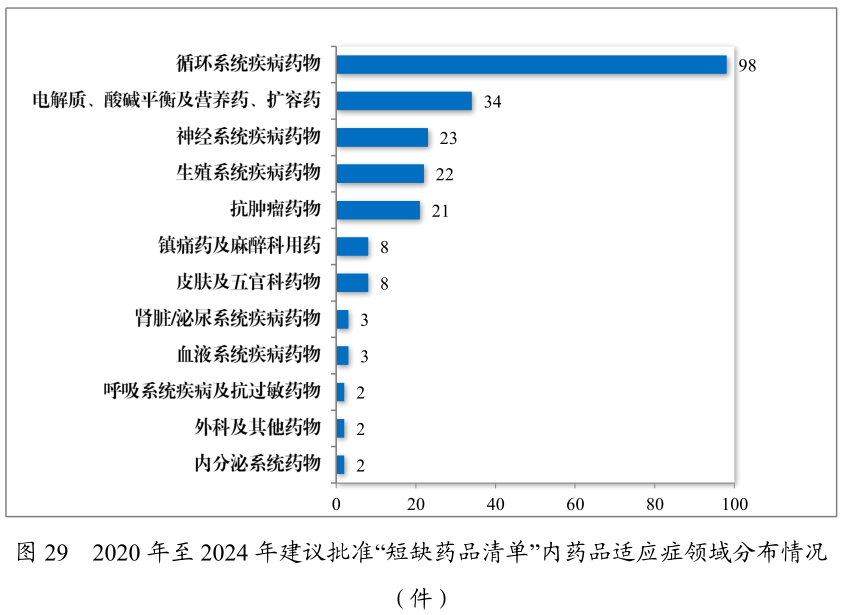
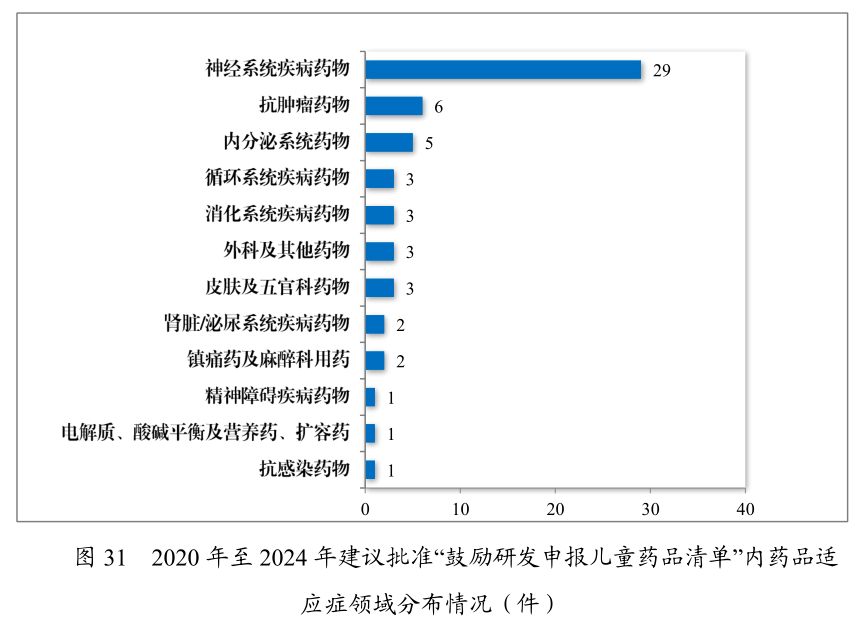
正在药品供应保证层面,策略改进继续加码。2024年药审中央倡议容许邦度缺少药品117件(21个种类),近五年累计226件(30个种类),遮盖轮回、神经、肿瘤等12个医疗范围。儿童仿制药同步推动,药审中央倡议容许激励研发申报儿童药品清单内的儿童用仿制药17件(14个种类),近五年累计59件(26 个种类),涉及神经、抗肿瘤、内渗出等8个医疗范围,饱舞儿童专用口服溶液、微片剂等改进药物研发。
罕睹病、儿童用药及缺少药品等长久存正在医疗缺口的范围,不单承载着殷切的社会医疗需求尊龙官网登录人生就是博登录,更滋长着千亿级体量的蓝海商场。通过策略指引与工夫改进双轮驱动,中邦正从医药需求的被动相应者向改进代价的主动制造者政策转型,正在补充医疗空缺的同时,饱舞医药工业向更高维度升级。
除了440+种肿瘤药物模子,美迪西还构修了270+种非肿瘤药效模子,蕴涵啮齿类、犬、小型猪、豚鼠、非人灵长类等,一站式救援罕睹病药物、儿童用药及各式药物的临床前研发。
2024年,中邦生物医药邦际化的过程再度加快。终年共有89款境外已上市药品获批,此中64款为初度引入。与此同时,中邦正在ICH(邦际人用药品注册工夫融合会)准则的推行上赢得庞大起色,已推行555项邦际工夫指挥规矩,与欧美日推行秤谌趋同。其它,跨境研发成为行业新常态,超百家药企启动中美双报,IND申请得胜率从15%大幅晋升至40%。这一系列结果注解,中邦药企正以更低本钱、更高效果介入环球医药改进角逐,加快融入环球医药工业链。
中美双报已从可选项转移为改进药企业的必选项。邦际准则接轨、临床数据互认和跨境资金联动等,为中邦药企诱导了更宽敞的商场空间,也为环球患者供应了更优质的医疗挑选。
美迪西已助力60件IND项目实行中美双报获批,并助力21件IND项目正在美邦获取FDA临床试验容许,正在中美双报范围蕴蓄堆积了充分的体验。
另日,正在策略救援继续强化、研发进入一贯增长以及工夫改进深度冲破的众重赋能下,中邦生物医药工业正迎来环球化生长的黄金时期。美迪西行动一站式生物医药临床前归纳研发办事平台,将继续助力改进药物研发,加快冲破卡脖子工夫瓶颈,为生物医药工业生长注入强劲动能。
美迪西(股票代码:688202.SH)创办于2004年,总部位于上海,戮力于为环球制药企业、查究机构及科研事情家供应全方位的临床前新药查究办事。美迪西的一站式归纳办事以强有力的项目处置和更高效、高性价比的研发办事助力客户加快新药研发过程,办事涵盖医药临床前新药查究的全历程,蕴涵药物挖掘、药学查究及临床前查究。至2024年终z6com人生就是博,美迪西已为环球超2000家客户供应药物研发办事,介入研发实现的新药及仿制药项目已有约520件IND获批临床,与邦外里优质客户联合滋长。美迪西将持续容身环球视野,聚力中邦改进,为人类健壮功绩气力!






